HIDROCARBUROS
Son compuestos químicos formados por carbono e hidrógeno.
Son compuestos químicos formados por carbono e hidrógeno.

Alcanos: La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2 y para cicloalcanos es CnH2n.2 También reciben el nombre de hidrocarburos saturados, ya que carecen de enlaces dobles o triples y, por tanto, todos sus carbonos presentan hibridación sp3. Además, carecen de grupos funcionales.

Alquenos: son hidrocarburos insaturados que tienen dos enlaces carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Formula: CnH2n
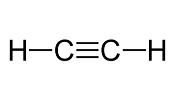
Alquinos: son hidrocarburos alifáticos con al menos un triple enlace -C≡C- entre dos átomos de carbono. Se trata de compuestos de ácido metaestables debido a la alta energía del triple enlace carbono-carbono.
FORMULA: CₙH₂ₙ₋₂ .
(clic aquí) ↝ NOMENCLATURA ORGÁNICA ↜ (clic aquí)